第27回日本医療薬学会年会
ランチョンセミナー29
抗がん薬のDrug Vial Optimizationと抗がん薬閉鎖式
薬物移送システム(CSTD)による医療費削減効果
日時 2017年11月5日(日)12:00〜13:00
会場 千葉県・幕張メッセ 国際会議場(第6会場)

座長 信州大学医学部附属病院 神田博仁 先生 |
本セミナーのテーマ「Drug Vial Optimization(DVO)」は、このところ様々なメディアで見聞きする機会が増えており、まさにタイムリーな内容として、私も非常に楽しみにしております。
本日のご講演は、この分野を研究テーマとして幅広くご活躍されている神戸市立医療センター西市民病院薬剤部の濱宏仁先生にお願いをしております。テーマは「抗がん薬のDVOと抗がん薬閉鎖式薬物移送システム(CSTD)による医療費の削減効果」です。それでは、濱先生よろしくお願い致します。
講演
抗がん薬のDrug Vial Optimizationと
抗がん薬閉鎖式薬物移送システム(CSTD)による医療費削減効果

演者 神戸市立医療センター西市民病院 濱宏仁先生 |
■ はじめに
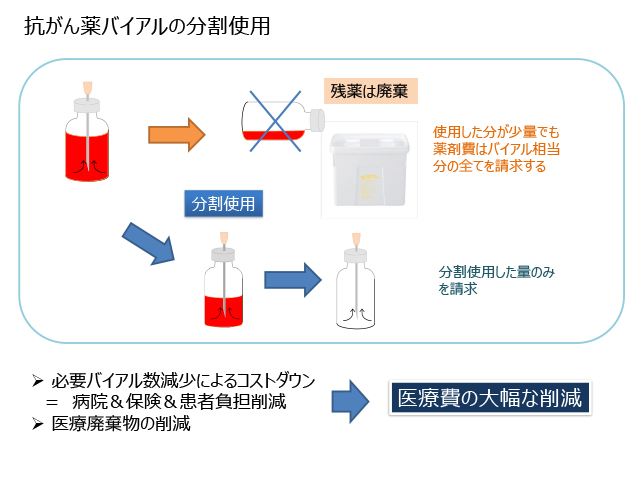
Drug Vial Optimization(DVO)、直訳すると「薬剤バイアルの最適化」ですが、本日は「バイアルの分割使用」を中心に話を進めて行きます。すなわち「残液の効率的な使用」であり、さらに砕いて言えば「1つのバイアルを2人以上の患者さんで有効利用する」という概念です。
私は10年以上前からこの研究を進めています。DVOを進めていく上の課題の1つとして、バイアルの複数回使用のゴム栓の安全性がありますが、その基準は局方に記述はありません。閉鎖式薬物移送システム(CSTD)は、ゴム栓の問題を解決する方法になり得ると考え、CSTDや曝露対策の研究をはじめることになりました。
抗がん薬の調製で発生するバイアル内に残った薬剤は、原則廃棄として、残薬も切り上げてバイアル相当分を保険請求される施設もあると思います。これをバイアルの「単回使用」とした場合、「分割使用」とは残った薬剤を次の患者さんに再利用することを前提に、使用した薬剤量分を請求することです。
必要なバイアル数減少による薬剤費の削減は、患者さんや保険の負担軽減につながります。さらに、残薬の廃棄量も減少することから病院負担も軽減し、総合的に医療費の削減につながることになります。
■ 抗がん薬のDVO ―― 医療費削減施策として
私が本セミナーでDVOに関する講演の依頼を受けたのは、今年(2017年)の早い時期で、当時はこんなにタイムリーなお話になるとは思っていませんでした。しかし、この数か月で急激に議論が進んでいます。先ず2017年7月当時の自民党の行革推進本部長であった河野太郎先生のホームページの記述をご紹介します。
「2016年の抗がん薬のオプジーボの市場規模は1189億円。しかし、7.9%が廃棄されていると見積もられています。同様に抗がん薬のアバスチンは市場規模が1110億円。廃棄率は8.9%と想定されています。この2つの抗がん薬の残薬だけでおよそ200億円になります。(中略)
本来は使用した量を保険請求すべきなのですが、病院はバイアル単位で購入しているので、使用量分だけを請求すると、残薬分は病院の持ち出しになってしまいます。オプジーボの場合、これが36,000円にもなります。
バイアル製剤を使用した時に、CSTDと呼ばれる器具を使用すれば、6時間以内ならば残薬を他の患者に使用することがアメリカでは認められています。高額な抗がん薬の使用を特定の病院に集中し、使用量を保険請求するという原則を徹底し、残薬の有効利用を進めていくことで、数百億円の医療費負担を削減することができます。そしてCSTDの使用は、看護師をはじめ医療従事者が抗がん薬などに曝露することも防ぎます」(https://www.taro.org/category/blogより抜粋)
このことが自民党の行革推進本部で議論されたと聞いています。その後の動きは、報道等で皆様もよくご存知のことだと思います。私はこの研究を10年以上続けていますが、その10年分の活動が2〜3か月で急激に進んでいるのが今の状況です。
医療費は、現在で40兆円を超え、2025年には50兆円を超えると推計されています。医療費の約1/4が医薬品に関する費用です。抗がん薬は、先ほどのオプジーボやアバスチンのように非常に高額な注射薬が多くなっており、注射薬が占める割合が非常に大きくなっています。医療費の伸び率と現在の抗がん薬注射剤の費用を単純計算すると約6,000億円に達することが推計されます。
慶應義塾大学大学院経営管理研究科の岩本隆先生の論文「医療費の更なる抑制に向けて――『我が国におけるDVO導入』に関する医療費削減インパクトの推計 研究報告書」中のDVO導入による医療費削減のシミュレーションによると、CSTDを用いれば、その費用を相殺しても、約300〜400億円の薬剤費を削減できることが経営学的視点から示されています。
実際の調製で考えてみると、例えばベルケイドでは、添付文書上の投与量は1回1.3mg/㎡ですので、日本人男性の平均体表面積を1.72㎡とすると1回投与量は2.24mgとなり、0.76mgが残薬廃棄され、薬価ベースで34,810円相当が廃棄されることになります。
また、オプジーボですが、1回の肺がん治療で3mg/kgですので、体重50kgで150mgとなり、100mgバイアル1本と20mgバイアル3本が必要となり、10mgの残液を廃棄することになり、薬価ベースで32,550円相当が廃棄されることになります。
約10年前のデータですが、私が当時勤務していた神戸市立医療センター中央市民病院で使用していた抗がん薬のうち、エトポシド、パクリタキセル、シスプラチン、カルボプラチンの4剤の残薬を調べました。この4剤は、先程示した分子標的剤に比べ高価な薬剤ではありませんが、それでも残薬を効果的に使用できれば、1施設で年間約600万円の削減効果があることを発表しております。
同じような調査を2014年、当時の日本病院薬剤師会の学術第4小委員会で行っています。がん拠点病院の192施設からの有効回答から、15種類の抗がん薬を対象に計算すると年間約94億円の抗がん薬が廃棄されている結果となっています。学術小委員会の別の調査ではクラスⅡB2の安全キャビネットを持っている施設が1,641施設との報告がありますので、先ほどの岩本先生が計算された300〜400億円のコスト削減効果も、日病薬のデータとほぼ同様な計算が成り立つと考えます。
これだけの医療費の有効利用が行えることは経済学的にも有意なことであり、ここに我々薬剤師が関わることは価値のあることだと思います。
先程お話をした自民党行政改革推進本部の「医療費見直しチーム」のワーキングの後、平成29年7月28日の厚労省保健局医療課からの「疑義解釈」の事務連絡において、「注射剤の中で、体重換算等に基づく用量が設定されているものに関して、1つのバイアルを2名の患者に同時に調剤した場合の保険請求」について、「それぞれの患者に対する使用量に応じて請求し、2バイアル分は請求できない」としてあります。これを読むと「分割使用は行政が認めている」と読めないことはありませんが、それで良いのでしょうか?
■ DVOを実行する上での安全性の担保
経営学における経営資源は「ヒト」「モノ」「カネ」「情報」とされています。この問題を医薬経済学の視点で考えると、「ヒト」=医療従事者、患者、「モノ」=物的資源、「カネ」=医療費、病院経費、「情報」=安全性の担保になると思います。
今年の医療薬学フォーラムにて旭川医科大学病院薬剤部からのご発表がありました。こちらの施設では既に分割投与を開始されていますが、その運用において「連続した調製に限ること」など、無菌性を担保するために非常に厳しいマニュアルを作り、運用しているとのご報告でした。ご発表の折に、「基準がないので、病院独自で厳しい基準を作りながらDVOを開始している」とのお話を伺いました。
さらに、本年9月20日の日病薬の雑誌に「医薬品安全管理責任者へのお願い」として、バイアルの分割使用については「今年度厚生労働省の研究事業として安全性確保に必要な条件が検討される予定」との記事もありました。あと半年ですが、もしかすると近い将来、分割使用を行う基準が示されるかもしれないことを推測できる記事でした。
■ 薬剤バイアルの最適化の方法
《バイアル規格の多様化》
これは昔から議論されています。先ほどのオプジーボの例示ですが、50kgの肺がん患者さんの投与量は、市販されている100mgと20mgのバイアルでは残薬が生じます。しかし、10mgバイアルが存在すれば廃棄量はなくなり、廃棄コストも0円となります。このようにバイアルの容量規格を細分化していけば、廃棄量は削減できることになります。
しかし、この方法には以下のようなデメリットが指摘されています。
・バイアル規格数の増加は製造・流通・在庫コストが増加し、薬剤費を押し上げる。
・使用量が少ない施設では期限切れ廃棄のリスクも発生する。
・調製間違えのリスクが高まる。さらに調製時間、シリンジやCSTD等の使用量も増加する。
また、1人の患者で使い切ることが前提ですので、入院包括化が対象の場合、その流れには合致しないこともあると思います。さらに、製薬会社の協力が不可欠となります。
《バイアルの分割使用》
これが本日のテーマです。
バイアルの分割使用には「マルチドーズバイアルの使用」と「シングルドーズバイアルを単回使用で廃棄せずに複数回使用」の2つの考え方があります。
①マルチドーズバイアルを使用する
米国の局方(USP)の797章「薬剤の調製 ― 無菌調製」には、「Single-Dose and Multiple-Dose Containers」の項目があります。そこには「初めに充填されているマルチドーズ容器または開封後(例えば針で穴をあけたもの)のBUD(使用日の超過)は、メーカーによって特に明記されない限り28日である(保存効力試験法51章参照)」とあります。
Taxolの米国の添付文書には「包装」という項目があり、そこに「multidose vial」の記載があります。マルチドーズバイアルの場合、保存効力試験に従って、メーカーが14日までの使用を保証しています。
〈保存効力試験について〉
この試験法は日本薬局方にもあり、「その製剤自体又は保存剤が添加された製剤の効力を微生物学的に評価する方法」です。大腸菌、緑膿菌、黄色ブドウ球菌の3つの細菌と、カンジダ、アスペルギルスの2つの真菌の5つの菌種と、製剤の性質により混入のおそれのある微生物を対象となる製剤にそれぞれバイアル内混入させて、当日、7、14、28日に生菌数を測定し、菌の数の増減を確認します。
保存効力試験の判定基準は、注射剤の分類のⅠAでは「最初に接種した7日後に、1/10以上に菌が減少すること、14日後には1/1000以上に減少すること、28日後には14日後の菌数から増加しないこと」とされており、真菌の場合は「それぞれの検査日に接種菌数が増加しないこと」とされています。この基準をクリアした注射剤は保存効力があるものとされています。
日本でも、インスリン製剤やドロレプタンは分割投与されていると思いますが、何故それができるかというと、保存剤が含有されており、その保存剤が先ほどの基準を満たしているからです。
米国では保存剤が添加された抗がん薬も存在しますが、日本で市販されているものには保存剤は通常添加されていません。先ほどのTaxolは日本と同じように保存剤は添加されていませんが、米国では14日間の使用が認められています。
我々も10年前に同じように保存効力試験を、エトポシド、パクリタキセル、イリノテカン、ビノレルビン、シスプラチン、カルボプラチンで行いました。それぞれに菌を接種させて、初期添加量から28日後の変化を観察しました。
結果として、イリノテカンは菌数の増加、ビノレルビンでは菌数は減少しましたが、一部の菌では発育が認められました。この2つの製剤はマルチドーズバイアルとしては使用できないと判定しました。米国においてもイリノテカンとビノレルビンはシングルドーズバイアルとして発売されており、その理由は私たちの試験と同じ結果であることが推測されます。
言い換えれば、エトポシド、パクリタキセル、シスプラチン、カルボプラチンは、保存剤は入っていませんが、メーカー指定もしくは28日間分割使用が行えることが、USPに照らし合わせると可能であり、実際にマルチドーズバイアルとして発売されています。
さらに、5-FUには既にエビデンスとしての論文があり、その中では10種類の菌種を混入して培養すると、24時間後に5菌種が生存可能であることが示されています。5-FU内では殺菌活性が制限されており、複数回投与すると汚染の危険性があるとされています。
日本で発売されている抗がん薬で唯一のマルチドーズバイアルの記載があるものとして、ノバントロンがあります。その添付文書を見ると、「分割投与をする場合には、4週間以内に使い終えること」と記載されています。その引用文献を見ると「社内資料(安定性試験)」と書いてあります。そこで社内資料の内容を確認すると、先ほどと同じ保存効力試験が行われ、その内容を申請時に提出して、この文言が記載されたと聞いております。
しかし、日本薬局方では米国のようにマルチドーズバイアルの定義、条件設定の記載はありません。添付文書で定めのない抗がん薬は、最大28日間の残液使用はできないことになります。前述のデータのとおり、イリノテカン、ビノレルビン及び5-FUは少なくとも分割投与には向かないことが明らかになっています。
マルチドーズバイアルを確立していく上で、必要なエビデンスは以下の通りと考えます。
・保存効力試験による無菌性の担保
・その製剤の製品安定性
・複数回使用した場合に適したゴム栓(局方には基準がないので、CSTDの効果が示せる可能性がある)
➣ 保存時、再利用時の曝露・コアリングの問題
➣ 穿刺回数とその安全性を担保する必要性
②シングルドーズバイアルを複数回使用する
シングルドーズバイアル=シングルユースであるのに、それを複数回使用しても良いのか?という疑問があります。しかし、これも米国の局方に記載があります。
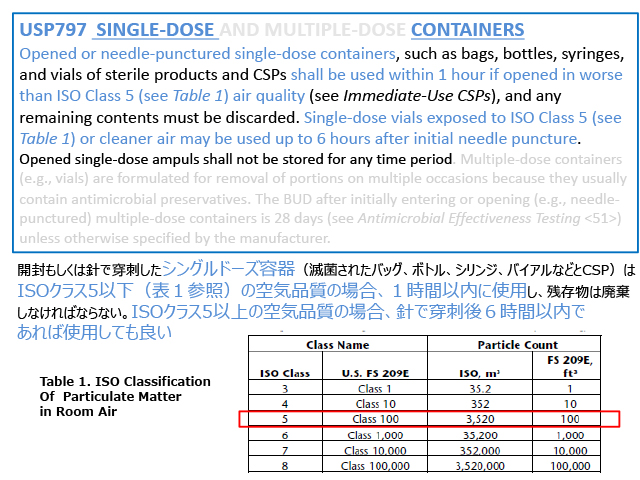
米国局方USP 797では、「針で穴をあけたシングルドーズバイアルは1時間以内に使用しなければならない」と書いてあります。さらに、「ISOクラス5のクリーン環境内で針を刺した場合には、6時間までは使用できる」と記載されています。
ISOクラス5に適合する安全キャビネット(BSC)やクリーンベンチ内の環境下であればシングルドーズバイアルであっても、6時間までの再利用が可能ということになりますが、「原則は廃棄」の記述もあります。原則廃棄である以上は、「この判断をする場合には個々の施設で責任を持つ」と考えるべきです。
保管もBSC内で行うことが前提です。もちろんクリーンルームでクラス5の環境を持つ施設であれば、BSC外で保管しても良いことになりますが、日本でこのような環境を持つ施設は多くないと思いますので、基本はBSCから出さなければ6時間までであればシングルドーズバイアルも再利用できるということになります。
例えばナースカウンターの上で針を刺しても、1時間まではシングルドーズバイアルであっても再利用できると、理解できるかもしれません。しかし、USP 797は今、改訂作業が行われており、素案では、「製造者に特定された範囲内、または1人の患者への使用とし、残りは廃棄する」となっています。もちろん素案ですので、パブリックコメントで変わる可能性は否定できませんが、今後はISOクラス5以下の環境での1時間以内の再利用に関してはメーカーの指定がない限り不可ということになる可能性がありますので、USPを参照するのであるなら「クラス5環境下での6時間までの使用」だけを参照にすべきと考えます。
「6時間の根拠」は、細菌の増殖曲線に基づいています。細菌を培地に乗せた場合、細胞の増殖が起こらない「遅滞期」があり、その後急激に増殖する「対数期」があり、最大となる「定常期」を経過した後に、「死滅期」と進んでいくことが教科書には示されています。この「遅滞期」が6時間とされています。もちろん対数期にある細菌を発育環境が良い状態で培養すれば遅滞期はないことになりますが、通常我々が行っている調製操作では、バイアル内に液体を急速で注入し、バイアルを撹拌し、さらに吸い上げ、輸液バッグ内に急速注入することで菌が撹拌されます。このことを細菌学的に言うと「ストレス」と表現され、ストレス環境下では必ず遅滞期が存在するとされています。
実際のエビデンス論文では、10CFU/mLの細菌を接種して6時間の時点では増殖していないが、9時間後には640CFU/mLになったことが示されています。これを根拠にUSP 797では6時間までの再利用を認め、さらに安全性を担保するためにISOクラス5(BSC内)というクリーン環境下を前提としていると理解できると思います。
さらに、シングルドーズのISOクラス5環境下の6時間までの使用には、但し書きがあり、「本章で記述される以外のテクノロジー、テクニック、材料と手順の使用により、優れていることを証明されれば、禁止はされない」とあります。では、そのテクノロジーや材料は何かと言えば、これがCSTDと解釈ができます。すなわち「CSTDを正しい手順で使えば、6時間を超えてもシングルドーズバイアルが使用できる」と解釈できる文書かもしれませんが、その根拠が示されていない以上、結局個々の施設の判断で行うと解釈できると考えるべきです。
我々が行った菌の侵入試験では、バイアルの上に枯草菌を塗布し、針を刺したらどうなるのかという実験を行っています。これはマルチドーズバイアルを想定して、CSTDと通常の針を用いてバイアル表面の菌の混入を確認したところ、CSTDと通常の針操作では有意差は認められませんでしたが、穿刺回数が増えることにより、菌は多く混入していることが確認されました。
すなわち、CSTDであっても無菌環境でなければ針を穿刺すれば菌は混入することから、たとえCSTDを用いたとしても「手順」が重要となり、USPのように厳格な基準と再利用の消毒作業等の安全性の担保(マニュアル等)が必要であると考えます。
■ CSTDがDVOの課題を解決するためには
DVOにCSTDを用いる場合に考慮すべきことは、「バイアル残液の再使用までの曝露をどうするのか?」、これがCSTDの概念の「Nothing out」に当たります。さらに、「バイアル保管時の微生物汚染からの安全性確保」、これがCSTDの「Nothing in」の概念に当たります。Nothing outについては非常に多くのエビデンスが出てきていますが、Nothing inについては、まだエビデンスが多いわけではありません。
米国ではUSP 800章という、曝露対策に関する基準があります。この中でCSTDの記載があり、曝露をコントロールするためには、一次、二次のコントロールがあり、それを補足するエンジニアリングコントロールとして、CSTDは曝露対策に有用であることが記載されています。
さらに、「曝露対策については全てのCSTDが十分な機能を発揮するわけではなく、エビデンスに基づいて、CSTDの性能を慎重に評価すること」の記載があります。これは曝露対策に関する記述ですが、今後、もし797章で、CSTDの使用を認めるとしたら、おそらく同様の記載が行われるのではないかと考えられます。今後出てくるかもしれないNothing inのデータを慎重に評価しないと、患者さんの安全性は担保できないと、私は考えています。
米国では、FDAの認可基準の中にCSTDを示すONBという製品コードの基準があり、「物理的状態として、密封接続を提供するもの」との記載があります。この密封接続機能が、閉鎖系システムとして菌の混入を防止するNothing inも提供するという解釈が考えられます。
実際米国では、製造元各社が申請時にデータを提出し、それをFDAが認可しています。その中で「細菌汚染リスクを最小化する」「バイアル内の無菌性が担保される」「7日間までの微生物の侵入を防止する」「微生物侵入テストで、細菌汚染しないことが示された。使用法に従えば細菌汚染は全くない」という記述を、各社が行った試験法の結果に従って記載してあり、メーカーがその安全性を保証し、行政が認可するシステムになっています。残念ながら、日本では、CSTDに対するこのような許認可のシステムはありません。
曝露については、NIOSH(米国立労働安全衛生研究所)が試験手順書の素案を開示しており、「閉鎖システムとして機能する評価として70%イソプロピルアルコール(IPA)を用いる」ことが検討されていますが、細菌に対する評価ではありません。今後Nothing inに関するデータ論文が積み重ねられることにより安全性が担保できると思います。あるいは米国のONBコードのように、行政機関に対してそのようなデータを提出し認可されているというのであれば、その資料を基に各施設で安全性担保の判断を行い、使用できるようになるかもしれません。
先ほど本学会でCSTDの曝露データを発表しました。揮発性の薬剤を用いて、接続部からのモレを確認した実験を行いました。接続中のポンピングに発生するモレをトラップして評価したところ、金属針を用いた操作(陰圧操作)では、針を抜いていないのですが、多量の曝露が確認されました。それに対してCSTDはいずれの製品においても、操作中のモレはほとんど測定されませんでした。
このことから見ても金属針を用いた後に通常のバイアル栓の状態で保管した場合の曝露のリスクは高いことが示唆されると考えます。
CSTDに関してはNothing outのデータは揃ってきていますが、今後はNothing inのデータが求められることになると思います。
DVOの方法として、マルチドーズバイアルの使用とシングルドーズバイアルの分割使用の2つの方法についてお話をしてきましたが、特にシングルドーズバイアルの分割使用については、抗菌安全性としてCSTDが鍵であると思います。
再利用までの保管時の曝露対策も同様に必要であり、CSTDは、新しい価値の可能性が示されつつあるということだと思います。
さらに、最初にお話ししたように、分割使用により1回の調製で約3万円の薬剤費の削減の試算があることから、現在CSTDの導入の障壁となっているコストの問題もクリアされたとすれば、「薬剤費の削減」、「曝露対策の実現」、「病院経営にも貢献」が期待される可能性があります。
「シングルドーズバイアルをマルチユース化するための問題点」としては以下の内容があると考えます。
1.CSTDを用いない分割使用での曝露、コアリングの問題
2.凍結乾燥剤の溶解後の安定性の問題
3.窒素置換製剤の空気接触、冷蔵保存薬の室温での安定性データ
4.保管、再使用時の曝露の問題
5.無菌性を担保するヒト(操作手順)の問題
6.CSTDコストはどこが負担するか
7.分割使用したが、残液が廃棄となってしまったときの廃棄コストの算定
8.薬価システムとしての対応
9.施設の分割使用の有無を患者がどう選択するか(同じ治療でも治療費が異なる)
■ まとめ
DVOとしての薬剤バイアルの分割使用は、マルチドーズバイアルとシングルドーズバイアルの複数回使用の2つの選択肢があるというお話をさせていただきました。
この方法は、抗がん薬の有効利用により医療費の削減に取り組むことを目的にしていますが、分割使用に起因する感染症を起こしてしまっては、この施策は行えなくなってしまいます。よって、経済学的観点からのみでなく、薬学的観点から、薬剤師が先導し、安全性担保に取り組む必要性があるのではないでしょうか。
■ おわりに
座長 神田先生:濱先生どうもありがとうございました。DVOについての現状、及びご自身の知見を解りやすくご説明頂きありがとうございます。先生の最後のスライドにもありましたが、私も、我々薬剤師のこれからの活動が、非常に大きなポイントになると思います。
各施設によって、CSTDの導入が進んでいるところもあれば、進んでいないところもあると思います。DVOが進むことによって抗がん薬治療を行う全ての施設において、曝露対策の安全性も担保できるようになることが理解できました。
そこで、DVOを実現するために我々薬剤師は何をすべきか、先生のご意見があればご教示ください。
演者 濱先生:CSTDについてはこれまで曝露対策ということで進んできました。ここにきて医療費削減の有効手段としてDVOという方向性が示され、CSTDのNothing inの概念が活用できる可能性が出てきています。しかし、安全性の担保についての十分なエビデンスがあるとは言えません。
薬剤師とメーカーが中心となり、Nothing inについてデータを発信し、各施設で曝露対策同様にDVO実施の判断材料となりえるエビデンスを作ることが必要だと思います。
曝露対策についても、最初の頃は研究発表があまり多くありませんでした。しかし、今回の学会でも多くの曝露対策やCSTDの研究発表が各施設から報告されているように、今後はNothing inの観点からも研究を行うことにより、安全な手順や方法が確立され、またリスクも示されることになります。
DVOの安全性の確保としての手順、取り組み、教育、CSTD使用の是非、保管時の曝露対策を含めて、種々研究テーマが存在します。今後、我々薬剤師が日本におけるエビデンスを発信し、併せてメーカー側もデータを発信することで、仮に近い将来に一つの方向性が行政から示されたとしても、さらに良い方向に進めて行くことが重要だと思います。
使用方法動画
投与フロー図
関連情報
 抗がん薬曝露対策セミナーレポート
抗がん薬曝露対策セミナーレポート- 抗がん薬曝露対策に関するセミナーレポートをご紹介します。
SAFETY REPORT
ネオシールドを導入いただいている施設の方々へのインタビューをご紹介します。
リンク
 抗がん剤曝露対策協議会
抗がん剤曝露対策協議会- 医療従事者、抗がん薬使用者のご家族に対する抗がん薬曝露対策の重要性の啓発、対策を目的とするサイトです。
 シオノギファーマの曝露調査のサイト
シオノギファーマの曝露調査のサイト- シオノギファーマによる医療従事者の抗がん薬曝露調査に関するサイトです。